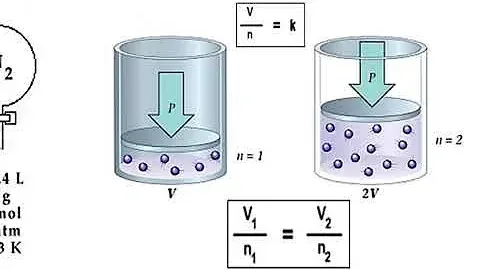
En el mundo fascinante de la química, ciertas leyes fundamentales propulsan nuestro entendimiento de cómo interactúan las sustancias a nivel molecular. Una de estas leyes esenciales es la Ley de Avogadro, establecida por el físico italiano Amodeo Avogadro en 1811. Esta ley vital declara que dos volúmenes iguales de diferentes gases, bajo las mismas condiciones de temperatura y presión, contienen el mismo número de moléculas. Así, dos botellas idénticas, una con oxígeno y otra con helio, tendrán la misma cantidad de moléculas aunque el número de átomos sea distinto debido a la naturaleza diatómica del oxígeno.
La Ley de Avogadro no solo es una declaración intrigante sobre gases, sino que tiene aplicaciones prácticas extensas. Permite que los científicos transformen volúmenes de gases en una cantidad determinada de partículas, facilitando experimentos y cálculos químicos. Por ejemplo, bajo condiciones normales, conocidas como temperatura de 0 °C y presión de 1 atmósfera, un mol de cualquier gas ocupará 22.4 litros. Si la cantidad molar se duplica, el volumen también se duplicará, manteniendo las condiciones constantes.
¿Quién fue Avogadro y cuál es su ley?
Amodeo Avogadro, un físico italiano del siglo XIX, contribuyó significativamente a la ciencia con su ley homónima. Su formulación establece una relación directa entre la cantidad de gas y su volumen a condiciones constantes de temperatura y presión. Este principio subraya que si incrementas la cantidad de gas, el volumen aumentará, y viceversa. Además, establece una base para comparar masas moleculares entre distintos gases, lo que resulta crucial para avances en estudios químicos y físicos.
¿Cuál es la fórmula de la Ley de Avogadro?
La fórmula de la Ley de Avogadro relaciona directamente el volumen de un gas (Vi) con su cantidad en moles (ni), a través de una constante de proporcionalidad (k): Vi = ni * k. Este sencillo pero poderoso enunciado matemático es indispensable para calcular cuántos moles de gas están presentes en un volumen dado, siempre considerando que se conozcan las condiciones de temperatura y presión.
¿Qué implica la ley de Avogadro?
Las implicaciones de la Ley de Avogadro son vastas y variadas. Una de las más llamativas es su aplicación al estudiar la expansión de gases. En la vida cotidiana, esto se puede observar cuando se inflan globos; el volumen del globo aumenta conforme lo hace la cantidad de moles de aire en su interior. No obstante, es crucial entender que los gases reales pueden desviarse de estos comportamientos ideales debido a las interacciones entre moléculas, especialmente bajo condiciones no estándares.
¿Cómo se aplica la ley de Avogadro?
En la práctica, la ley ayuda a entender y a prever el comportamiento de los gases bajo cambios de condiciones. Por ejemplo, al inflar un globo se aumenta el número de moles de aire, incrementando así su volumen de acuerdo con la ley. Este principio también es esencial en laboratorios para determinar la composición química de muestras de gases. La habilidad para estimar el número de moléculas en volúmenes específicos es fundamental para la química analítica y la síntesis química.
La Ley de Avogadro en México
En México, la aplicación de la Ley de Avogadro se manifiesta a través de numerosos estudios y experimentos científicos. Se han realizado investigaciones que confirman la ocupación de 22.4 litros por mol de gas en condiciones normales. Además, se estudian los impactos biológicos y ambientales de los gases, aspectos crucial para entender cómo los cambios en la atmósfera afectan nuestra salud y el entorno.
¿Cuál es la importancia de la ley de Avogadro en la química?
La importancia de la Ley de Avogadro trasciende los laboratorios de química, influenciando cómo entendemos las propiedades y comportamientos de los gases. Facilita cálculos exactos en la estequiometría de reacciones químicas y ayuda a modelar sistemas que dependen del comportamiento gaseoso. En resumen, esta ley es un pilar en la educación y aplicación de la ciencia química, permitiendo avances significativos en la industria, la investigación y la educación.
Con su base en principios simples pero profundamente significativos, la Ley de Avogadro continúa siendo una herramienta esencial para científicos alrededor del mundo, iluminando el comportamiento de los gases y fortaleciendo el vínculo entre la teoría química y las aplicaciones prácticas.